欢迎访问微众生物企业官网!
欢迎访问微众生物企业官网!

HE染色是病理学、组织学和胚胎学研究中常用的染色技术,今天,为大家带来详细的HE染色实验步骤及常见问题解析,助你轻松搞定HE染色!
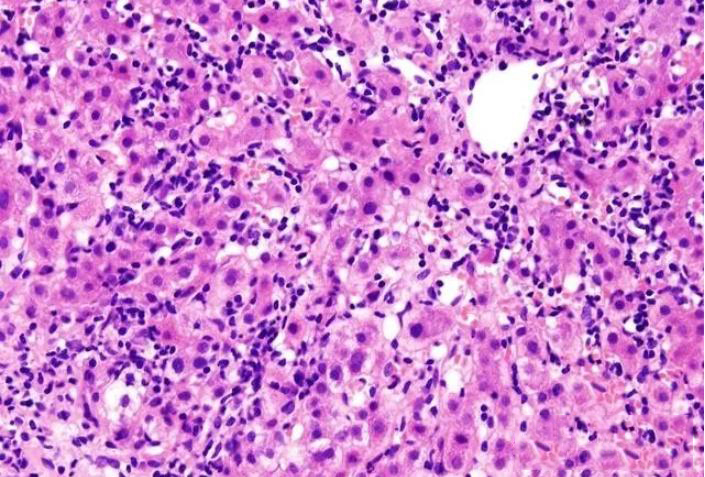
一、HE染色原理
HE染色法通过碱性染料苏木精和酸性染料伊红,分别使细胞核和细胞质着色。苏木精染液使细胞核呈紫蓝色,而伊红使细胞质和细胞外基质呈红色。这种染色方法能够清晰地反映出组织结构和细胞层次。
二、染色步骤
样品制备
对贴壁生长细胞,使用胰蛋白酶来处理,调整细胞浓度约1×10⁵/ml,将调整好浓度的细胞悬液滴加到放置在6孔板中的盖玻片上,经过一段时间的培养后,细胞已经附着并生长在盖玻片上,此时将盖玻片从6孔板中取出,用PBS 洗涤3次,去除细胞表面残留的培养基、血清、代谢废物以及其他可能干扰后续实验的物质。
样品固定
使用95%乙醇固定20分钟,用PBS洗涤2次,每次1分钟。
染核
苏木精染液染色2-3分钟,自来水洗涤。
分色
显微镜下观察,若细胞核染色过深,用1%盐酸酒精溶液分色数秒,自来水洗涤。
染胞质
浸入伊红染液染色1分钟,用自来水洗涤。
封片
吹干或自然晾干细胞爬片后,用中性树胶封片。
三、漂亮的HE染色实验结果细胞核呈蓝色,细胞质、肌纤维、胶原纤维和红细胞呈不同程度的红色,钙盐和细菌可呈蓝色或紫蓝色。
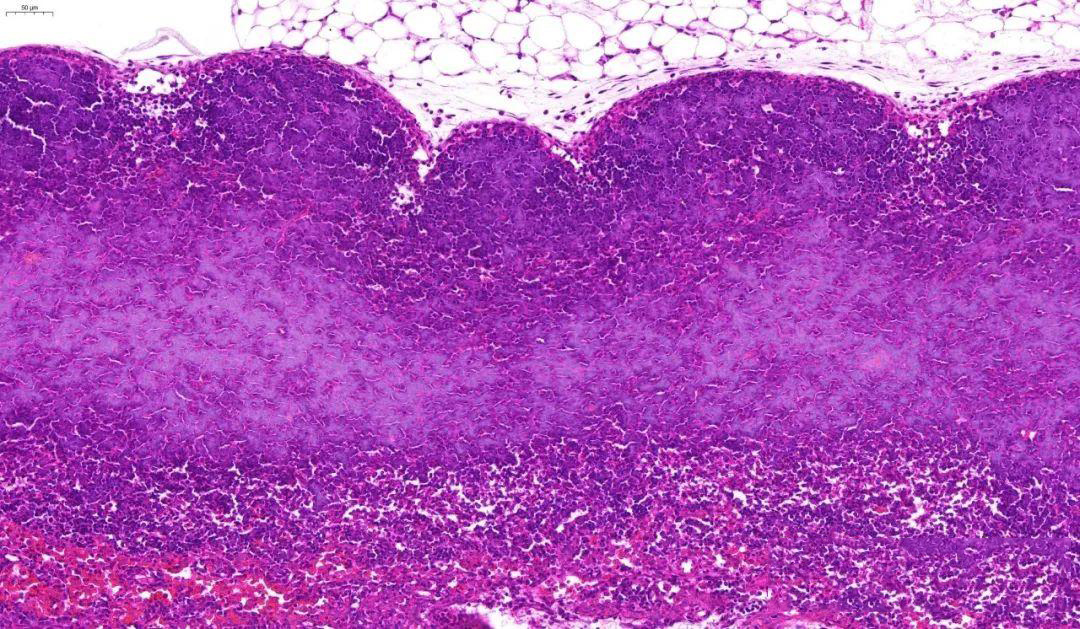
四、糟糕的HE染色常见问题
切片污染原因:苏木精染液的氧化膜或伊红染液的絮状沉淀和其他试剂中的沉淀物所致;切片和贴片过程中,被其他病例的组织和细胞污染;取材时也可能造成污染。
解决方案:定期过滤染液和试剂;摊片时小心操作;恒温贴片盆的水要常换或于每例贴片后用纸在水面及时把残余的蜡片拖走,以保证不污染。
细胞核染色苍白暗淡原因:切片在苏木精染色液停留时间过短;苏木素染色液过度氧化,失去染色能力;盐酸酒精的分化步骤处理时间过长。
解决方案:更换新的苏木素,调节染色和分化时间。
染色不均匀,呈雾化状态原因:常见于冬季室温低时,二甲苯脱蜡不彻底,导致组织处理不当。
解决方案:将二甲苯缸适当加温到30℃再脱蜡,或更换新的二甲苯。
切片在脱蜡后出现大片白色斑点原因:烤片温度太低;脱蜡时间不足;二甲苯使用过久。
解决方案:确保烤片温度和时间足够,更换新的二甲苯,进行重新染色程序的染色。
细胞核染色过深,胞浆着蓝色原因:苏木素染色时间过长;切片太厚;分化时间太短。
解决方案:镜下观察切片厚度,重新染色或制片。
伊红染色较淡原因:伊红pH改变;蓝化液残留;切片太薄;脱水时间过长。
解决方案:检查伊红染色液pH,调整实验步骤。
染色时切片脱落原因:组织脱水,透明不佳;石蜡未完全渗入,脱蜡时组织收缩,复水时组织又吸水膨胀,造成脱片;切片太厚、破碎、不整齐;染色前入水步骤不够,组织吸水后快速膨胀,导致脱片。
解决方案:确保组织脱水、透明彻底,切片厚度适中,染色前入水步骤足够。对发脆发硬的组织可用棉签蘸5%氨水或2%冰醋酸溶液涂抹在组织表面10-15秒,然后精修出组织面,放入冰水混合物中泡1min,再切片。血栓、坏死或硬度较大的组织在染色时本身就极易脱落,应小心操作。
染色模糊不清,灰染原因:组织未及时固定,部分自溶;固定不佳,深部组织未处理到;包埋时蜡的温度过高、脱蜡不彻底、分化过度导致的颜色变淡等。
解决方案:重新固定组织,确保包埋和脱蜡步骤正确。
无法染色或淡染原因:组织固定时采用酸性甲醛、组织在甲醛中浸泡时间太长。
解决方案:使用新鲜的中性甲醛固定,或在存放的甲醛中加碳酸钠中和甲酸。对于已经制出的片子,染色前采用5%重铬酸钾溶液浸泡半小时以上,然后自来水漂洗5min,可改善染色。
出现类似小水珠物质原因:脱水过程不彻底、中性树胶封片前组织切片已经干涸。
解决方案:用二甲苯彻底脱去封片胶,并重新封片。
出现色素沉淀物原因:切片染色后封固时,切片中的二甲苯已完全挥发或切片不经过二甲苯透明,此时树胶不能完全封固切片,而形成干燥的空气气泡或腔隙。树胶封固剂过稀,封固当时切片内并不出现黑点,当封固剂干燥或二甲苯挥发后切片内可出现小黑点。树胶浓度过高,流动不均匀,滴加的封固剂不能完全覆盖切片。
解决方案:切片染色后,经过苯酚-二甲苯混合液(1:3)处理或纯二甲苯充分透明后再用树胶。封固,可防止该色素颗粒产生。调整树胶浓度,可湿封固。
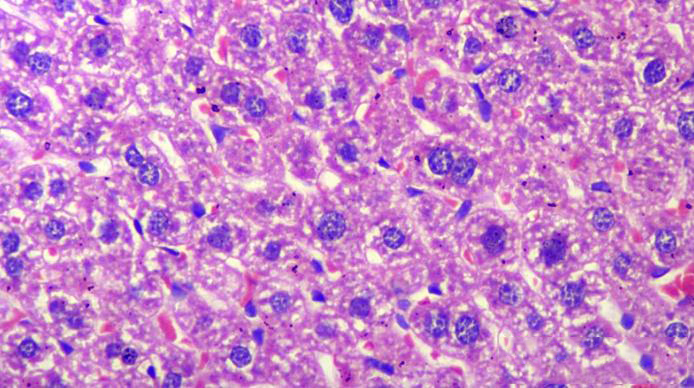
HE染色虽然基础,但每一步都至关重要。希望通过这篇详细的实验步骤及常见问题解析,能够帮助大家轻松搞定优质染色。
文章出自:病理检测外包 想了解更多请关注:https://www.vv-gene.com/
2026-02-09
吉姆萨染色“助攻”凋亡细胞检测2026-02-06
病理组织切片实验你了解多少?2026-02-03
码住!OCT包埋干货2026-01-31
脂肪组织石蜡切片,脱水时间大家如何掌握?2026-01-28
普通组织石蜡包埋切片步骤及注意事项